Валентность атомов элементов второго периода ограничена четырьмя в связи с особенностями электронного строения этих атомов. Второй период включает элементы от лития до неона, и все они имеют два электронных уровня — первый и второй.
Максимальная валентность атома определяет количество связей, которые он может образовать с другими атомами. Валентность вещества зависит от числа внешних (валентных) электронов, которые принимают участие в химической реакции. Валентность атомов элементов второго периода ограничена четырьмя, потому что у этих атомов валентные электроны расположены на s- и p-орбиталях.
Атомы второго периода валентной электронной оболочкой обладают 2s-орбиталем и 2p-орбиталями. Всего валентных электронов в этих орбиталях четыре, поэтому максимальная валентность атомов второго периода ограничена числом четыре. Это объясняет, почему максимальная валентность элементов такого периода, например, углерода или кислорода, равна четырем.
Причины ограничения максимальной валентности атомов элементов второго периода
Максимальная валентность атомов элементов второго периода (ли, бериллий, бор) ограничена четырьмя по нескольким причинам.
Во-первых, эти элементы имеют электронную конфигурацию s2. Это означает, что в их внешней электронной оболочке находятся всего два электрона. Каждый электрон в атоме имеет свой спин, который может быть вращением в одном из двух направлений: «вверх» или «вниз». По принципу исключения Паули, внешняя оболочка может вместить только два электрона с противоположными спинами.
Во-вторых, элементы второго периода имеют достаточно высокий заряд ядра, что создает сильное электростатическое притяжение к электронным оболочкам. Это делает сложным исключение из электронной оболочки единственного электрона, который есть у этих элементов. Именно этот электрон и может участвовать в химических связях с другими атомами, образуя две связи.
Таким образом, из-за электронной конфигурации и заполненности электронной оболочки, атомы элементов второго периода имеют ограниченные возможности для формирования химических связей и максимальная валентность этих атомов ограничена четырьмя.
Электронная конфигурация атомов элементов второго периода
Второй период таблицы Mendeleevа состоит из элементов от лития до неона. Все атомы элементов второго периода имеют 2 энергетических уровня: K и L. Атомы элементов второго периода могут иметь от 2 до 8 электронов в оболочке. Оболочка K может содержать только 2 электрона, а оболочка L — до 8 электронов.
Каждый атом стремится достичь электронной конфигурации, аналогичной электронной конфигурации инертного газа из предыдущего периода. Газы из предыдущего периода (гелий, неон, аргон и др.) имеют полностью заполненные внешние оболочки и стабильные электронные конфигурации.
Валентность атома — это число связей, которые может образовать атом с другими атомами. Оно определяется количеством электронов в внешней оболочке атома.
Атомы элементов второго периода имеют различные электронные конфигурации и, следовательно, различную валентность. Например, литий имеет электронную конфигурацию 2-1, а кислород — 2-6. Это означает, что литий может образовывать одну связь, а кислород — две связи.
Максимальная валентность атомов второго периода ограничена четырьмя, потому что внешняя оболочка может содержать не более 8 электронов. Атомы, у которых количество электронов в внешней оболочке больше 4, стремятся либо заимствовать 4 электрона, либо отдать свои все электроны, чтобы достигнуть стабильной электронной конфигурации.
Таким образом, максимальная валентность атомов элементов второго периода ограничена четырьмя из-за их электронной конфигурации и желания достичь стабильной электронной конфигурации.
Формирование первых энергетических уровней
Почему максимальная валентность атомов элементов второго периода ограничена четырьмя? Ответ на вопрос лежит в процессе формирования энергетических уровней атомов.
Атомы элементов второго периода имеют два энергетических уровня: первый и второй. Первый уровень может вместить максимум два электрона, а второй уровень — восемь электронов. Это объясняет ограничение максимальной валентности атомов второго периода до четырех.
На первом энергетическом уровне находятся s-орбитали, способные вместить два электрона. На втором уровне находятся s- и p-орбитали, способные вместить восемь электронов. Максимальная валентность атомов второго периода ограничивается максимальной заполненностью этих энергетических уровней.
Таким образом, формирование первых энергетических уровней атомов второго периода определяет максимальную валентность этих атомов. Это связано с распределением электронов по орбиталям и ограничениями по заполненности каждого уровня.
Заполнение второго энергетического уровня
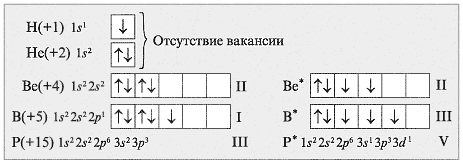
Второй энергетический уровень атома включает 2s и 2p подуровни. Подуровень 2s состоит из одной s-орбитали, что позволяет в сумме вместить 2 электрона. Второй энергетический уровень также содержит три подуровня 2p, каждый из которых состоит из трех p-орбиталей. Каждая p-орбиталь может вместить по 2 электрона, что в сумме дает возможность разместить 6 электронов.
Всего на втором энергетическом уровне может быть размещено 8 электронов. Объясняется это тем, что в соответствии с принципом заполнения электронных оболочек, сначала размещаются электроны в более низкоэнергетических орбиталях до заполнения всех доступных орбиталей, а затем уже размещаются в орбиталях более высокой энергии. Таким образом, на втором энергетическом уровне все орбитали заполняются до 2p, что ограничивает максимальную валентность атомов элементов второго периода четырьмя.
| 2s | 2p |
| 2s_ | 2p_x |
| 2s_ | 2p_y |
| 2p_z |
Локализация электронов в атоме
Локализация электронов в атоме ограничивает максимальную валентность атомов элементов второго периода четырьмя. Валентность атома определяется количеством электронов, которые могут быть вовлечены в химические связи с атомами других элементов.
Атомы элементов второго периода имеют четыре электрона в своем внешнем энергетическом уровне. Каждый электрон может быть связан с другим атомом в химической реакции. Однако, по принципу запрета Паули, в каждом атоме одной электронной оболочки не может находиться более двух электронов с противоположными спинами.
Таким образом, в атоме второго периода первый энергетический уровень (K-оболочка) может вместить максимум два электрона, а второй энергетический уровень (L-оболочка) — еще два электрона. После того, как атом заполняет свои энергетические уровни, он достигает наиболее стабильного состояния и больше не может вступать в дополнительные химические связи.
Таким образом, максимальная валентность атомов элементов второго периода ограничена четырьмя, так как они могут образовывать до четырех химических связей, используя свои четыре внешних электрона.
Основное состояние электрона и его параметры
Основное состояние электрона имеет несколько параметров:
1. Главное квантовое число (n). Главное квантовое число определяет энергию электрона и его дистанцию от ядра. Значение главного квантового числа может быть любым целым числом от 1 до бесконечности.
2. Орбитальное квантовое число (l). Орбитальное квантовое число определяет форму орбитали, на которой находится электрон. Значение орбитального квантового числа может быть любым целым числом от 0 до (n-1).
3. Магнитное квантовое число (m). Магнитное квантовое число определяет ориентацию орбитали в пространстве. Значение магнитного квантового числа может быть любым целым числом от -l до l.
4. Спиновое квантовое число (s). Спиновое квантовое число определяет направление вращения электрона вокруг своей оси. Значение спинового квантового числа может быть +1/2 или -1/2.
Основное состояние электрона и его параметры играют важную роль в понимании строения атома и его химических свойств. Понимание этих параметров позволяет объяснить, почему максимальная валентность атомов элементов второго периода ограничена четырьмя.
Принципы заполнения энергетических уровней атома
Первый принцип — принцип заполнения: электроны заполняют энергетические уровни в порядке возрастания их энергии. Так, на первом энергетическом уровне может находиться не более 2-х электронов, на втором — не более 8-ми и т.д. По мере заполнения уровней, энергия электронов возрастает.
Второй принцип — принцип слоев: энергетические уровни атома разделены на подуровни — s, p, d, f. Подуровни s могут содержать только 2 электрона, p — 6 электронов, d — 10 электронов, f — 14 электронов. При заполнении электронной оболочки электроны сначала заполняют уровни s, затем p и т.д.
Третий принцип — принцип группировки: электроны предпочитают размещаться на одном уровне в различных подуровнях вместе, образуя спаренные парами. Это означает, что на уровне с p-подуровнями на каждом подуровне должны находиться по 2 электрона.
Поэтому, второй период элементов второго периода имеет ограничение по максимальной валентности — четыре электрона. Например, у атома кислорода, наиболее распространенного элемента во втором периоде, в электронной оболочке находся 2 электрона на s-подуровне и 4 электрона на p-подуровне, что и объясняет его валентность равную четырем.
Строение молекул атомов второго периода
Максимальная валентность атомов элементов второго периода ограничена четырьмя, что означает, что в их внешней электронной оболочке может быть не более четырех электронов.
Строение молекул атомов второго периода обусловлено электронной конфигурацией атома. Атомы второго периода имеют две электронные оболочки: внутреннюю и внешнюю.
Внешняя электронная оболочка атома второго периода состоит из 4 электронов, размещенных на s и p орбиталях. Эти электроны заполняются по принципу, известному как правило авогадро, согласно которому электроны сначала заполняют s-орбитали, а затем p-орбитали.
Таким образом, атом второго периода может образовать только 4 электронные пары, соединяясь с другими атомами посредством обмена электронами. Из-за ограниченности валентности атомов второго периода, молекулы данных элементов имеют своеобразное строение и свойства.
Строение молекул второго периода может быть описано через образование ковалентных связей между атомами. Ковалентные связи образуются путем совместного использования электронов внешней оболочки атомов. Каждый атом в данной молекуле вносит свои электроны для образования общих электронных пар, которые обеспечивают стабильность молекулы.
Структура молекул второго периода определяется количеством ковалентных связей, которые каждый атом может образовать. Валентность атома, определяющая количество ковалентных связей, зависит от количества электронов во внешней электронной оболочке. Максимальная валентность атомов второго периода равна 4, поскольку она соответствует количеству электронов, которые можно разместить на s и p-орбиталях.
Таким образом, максимальная валентность атомов элементов второго периода ограничена четырьмя из-за особенности их электронной конфигурации и возможности образования только 4 электронных пар.
Формирование связей между атомами
Связи между атомами второго периода элементов образуются на основе их валентности. Валентность атома указывает на количество электронов, которые может принять, отдать или поделить с другими атомами, чтобы достичь электронной конфигурации с полностью заполненными энергетическими уровнями.
Максимальная валентность атомов элементов второго периода ограничена четырьмя, потому что общее количество электронов на втором энергетическом уровне составляет 8. Первый энергетический уровень содержит 2 электрона, а второй — 6 электронов. Основываясь на принципе октета, при котором атом стремится заполнить свой внешний энергетический уровень восьмью электронами, атомы второго периода имеют валентность не более 4, так как для достижения полностью заполненного энергетического уровня им необходимо получить или отдать еще 4 электрона.
Таким образом, атомы второго периода могут формировать связи с другими атомами, обменивая или делая совместное использование своих электронов, чтобы обеспечить достижение стабильной электронной конфигурации. Наиболее распространенные типы связей, которые образуют атомы второго периода, включают ковалентные связи и ионные связи.
| Валентность | Тип связи | Пример |
|---|---|---|
| 1 | Ковалентная | Связь между двумя атомами кислорода в молекуле О2 |
| 2 | Ковалентная | Связь между атомами кислорода и атомами водорода в молекуле H2O |
| 3 | Ковалентная | Связь между атомами азота в молекуле N2 |
| 4 | Ковалентная или ионная | Связь между атомами углерода в органических соединениях или связь между атомами кислорода и атомами катионов в оксидах |
Валентность атомов элементов второго периода и их способность формировать связи важны для объяснения химических свойств этих элементов и образования различных соединений.
Вопрос-ответ:
Почему атомы элементов второго периода имеют максимальную валентность равную четырем?
Максимальная валентность атомов элементов второго периода ограничена четырьмя из-за особенностей их электронной конфигурации. Валентность атома определяется числом электронов, участвующих в химических связях. Во втором периоде элементов электронная конфигурация атомов может быть представлена формулой 2s²2p⁶, где s — внутренняя оболочка, а p — внешняя оболочка атома. Оба типа оболочек второго периода, s и p, могут содержать максимум по 2 электрона, поэтому валентность этих атомов ограничена четырьмя.
Почему валентность атомов элементов второго периода не может превышать четырех?
Валентность атомов элементов второго периода не может превышать четырех из-за особенностей их электронной структуры. Во втором энергетическом уровне (втором периоде) находятся два подуровня: s-подуровень с двумя местами и p-подуровень с шестью местами. Каждое место может быть заполнено по два электрона. Соответственно, суммарно во втором энергетическом уровне может находиться максимум 8 электронов. Валентность атома определяется числом электронов, участвующих в химических связях. Таким образом, максимальная валентность для атомов второго периода равна четырем.
Почему максимальная валентность атомов элементов второго периода составляет четыре электрона?
Максимальная валентность атомов элементов второго периода составляет четыре электрона из-за особенностей их электронной структуры. Во втором периоде элементов находятся два подуровня энергии: s-подуровень с двумя электронами и p-подуровень с шестью электронами. Валентность атома определяется числом электронов, участвующих в химических связях. Поскольку каждый подуровень может содержать максимум по 2 электрона, определенная группа атомов имеет ограниченную валентность, равную четырем электронам.
Почему атомы элементов второго периода имеют ограниченную максимальную валентность?
Максимальная валентность атомов элементов второго периода ограничена четырьмя потому, что второй период содержит элементы с электронной конфигурацией ssps, где s-подуровни могут вместить не более 2 электронов, а уровень p — не более 6. Следовательно, на втором энергетическом уровне могут быть расположены не более 8 электронов, что соответствует 2 электронам s-подуровня и 6 электронам p-подуровня.
Почему максимальная валентность атомов второго периода составляет 4 электрона?
Максимальная валентность атомов второго периода ограничена четырьмя, так как у этих атомов валентная оболочка имеет четыре энергетических уровня. На каждом энергетическом уровне может располагаться максимум 2 электрона s-подуровня и 6 электронов p-подуровня. Следовательно, общее количество электронов, которое может находиться на валентной оболочке атомов второго периода, не превышает 32 (2+6+6+6+6+6).
Почему валентность атомов элементов второго периода ограничена?
Максимальная валентность атомов элементов второго периода ограничена из-за особенностей электронной конфигурации. Второй период содержит элементы с электронной конфигурацией ssps, где s-подуровни могут вместить не более 2 электронов, а уровень p — не более 6. Это означает, что на втором энергетическом уровне может быть не более 8 электронов, а следовательно, максимальная валентность ограничена числом 4.